Регистрация по правилам РФ
Регистрация медицинских изделий по правилам РФ
Правила государственной регистрации медизделий (МИ) в Российской Федерации утверждены Постановлением Правительства РФ от 27.12.2012 № 1416 «Об утверждении Правил государственной регистрации медицинских изделий».
Государственная услуга по регистрации медицинских изделий предоставляется в соответствии с Административным регламентом Федеральной службы по надзору в сфере здравоохранения (Росздравнадзор), утвержденным приказом Федеральной службы по надзору в сфере здравоохранения от 6 мая 2019 г. N 3371.
Заявителем при регистрации МИ может быть:
- разработчик МИ
- производитель (изготовитель) МИ
- уполномоченный представитель производителя (изготовителя) МИ
Для регистрации МИ в Росздравнадзор необходимо предоставить следующие документы:
1) заявление о государственной регистрации МИ;
2) доверенность, подтверждающую полномочия уполномоченного представителя производителя (изготовителя);
3) сведения о нормативной документации на медицинское изделие;
4) техническую документацию производителя (изготовителя) на медицинское изделие;
5) эксплуатационную документацию производителя (изготовителя) МИ, в том числе инструкцию по применению или руководство по эксплуатации МИ;
6) фотографические изображения общего вида медицинского изделия вместе с принадлежностями (размером не менее 18 x 24 сантиметра);
7) протокол и акт оценки результатов технических испытаний МИ;
8) протокол и акт оценки результатов токсикологических исследований МИ, использование которого предполагает наличие контакта с организмом человека;
9) документы, подтверждающие результаты испытаний МИ в целях утверждения типа средств измерений (в отношении МИ, относящихся к средствам измерений в сфере госрегулирования обеспечения единства измерений);
10) для МИ 1 класса потенциального риска применения и МИ для диагностики in vitro - сведения, подтверждающие клиническую эффективность и безопасность медицинских изделий;
11) проект плана клинических испытаний МИ с обосновывающими его материалами (при наличии);
12) сведения о выданных Росздравнадзором разрешениях на ввоз МИ с целью их госрегистрации (для МИ иностранного производства);
13) копии документов, подтверждающих качество лекарственного препарата, фармацевтической субстанции, биологического материала и иного вещества, с использованием которых произведено МИ или которые входят в его состав.
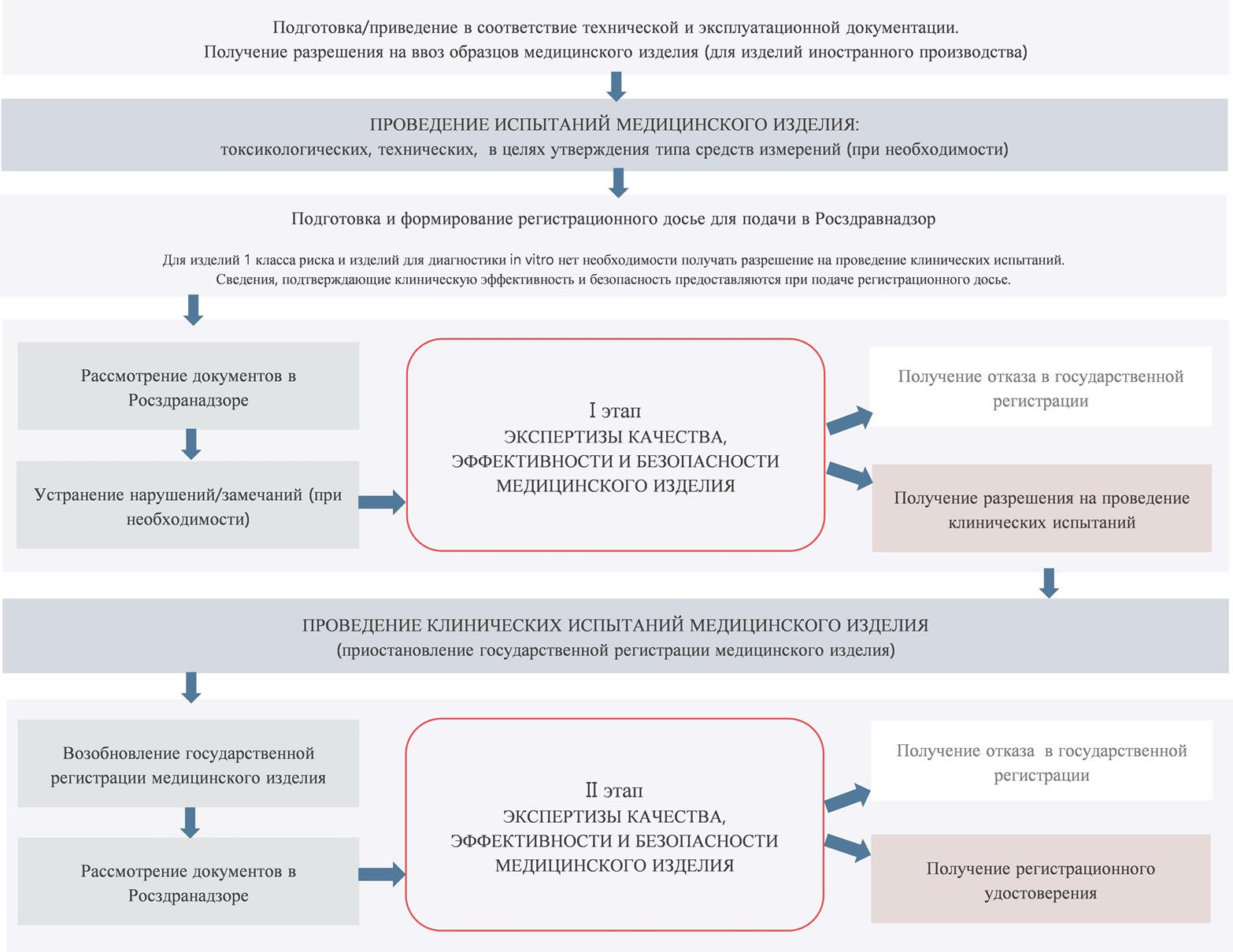
Схема регистрации медицинского изделия
Государственная пошлина
Размер государственной пошлины с 01.01.2022г.:
- за выдачу регистрационного удостоверения – 11 000 рублей
- за проведение экспертизы качества, эффективности и безопасности МИ:
класс 1 - 72 000 рублей
класс 2а - 104 000 рублей
класс 2б - 136 000 рублей
класс 3 - 184 000 рублей
В НАШИ УСЛУГИ ПО РЕГИСТРАЦИИ МЕДИЗДЕЛИЙ ВХОДИТ
технической
документации
регистрационного
досье
испытаний и
исследований
сопровождение
процесса
регистрации
Для получения консультации
отправьте запрос, специалист свяжется с Вами
в ближайшее время
2002 - 2024 © РЕСТА-КОНСАЛТ
Создание и поддержка сайтов: Web Design Master
|
|
